瑞德西韦成"神药"?先别吹,还要看实验结果(组图)
好消息!舆论漩涡中的抗病毒药物瑞德西韦(remdesivir)临床试验在武汉启动了,首批新型冠状病毒感染的肺炎重症患者2月6日将接受用药。
在迟迟未有特效药的情况,在美国进行临床试验的瑞德西韦走入公众视野。此药因专利申报的时间点和主体人引发了不小的舆论争议。目前,部分专家看好此药。中国工程院副院长、中国医学科学院院长王辰院士在《新闻1+1》上也透露:“根据前期的结果,我们对瑞德西韦抱有比较大的希望,其他药物包括中药,我们都需要进一步的临床观察来确定其疗效。”
不过,王辰院士也提醒道:“各界对这一试验有期望,但有无效果,还需要等待严格的科学试验结果。”
但人们显然期望更大,6日晚间,网上传言700余例患者全部显效,24小时96%的肺部感染都奇迹般恢复了。对此中日友好医院曹彬教授辟谣:“临床研究今天才开始,怎么可能出结果?科学研究需要时间。”而钟南山近日也表示,临床试验可以加快绿色通道,但必须走程序。

中国工程院副院长、中国医学科学院院长王辰
除了瑞德西韦,磷酸氯喹、法匹拉韦,以及中成药中也被发现在体外具有抗病毒活性,为何选中瑞德西韦开展临床试验?新药从研发到上市需要经过哪些流程?网易科技《态℃》栏目组对此些疑问进行了总结梳理。
体外抗病毒活性有效药:瑞德西韦不是唯一
还记得此前一则《上海药物所、武汉病毒所联合发现:双黄连可抑制新型冠状病毒》新闻,造成双黄连网上断货、线下排队、甚至连兽用双黄连也被一抢而空的“盛况”吗?双黄连等中成药中确实被发现具有抗病毒活性,但有个前提是“体外细胞实验”。然而,从体外细胞实验走入人体的临床研究还有很漫长的路要走。
除了双黄连等中成药,还有瑞德西韦、磷酸氯喹、法匹拉韦等药物也被发现具有抗病毒活性。
在2月4日国家卫生健康委召开的新闻发布会上,科技部生物中心副主任孙燕荣介绍,目前已经发现了磷酸氯喹以及中成药中具有抗病毒活性的药物。磷酸氯喹已经上市,在体外研究当中已经展示出了非常好的抗新型冠状病毒的活性。
据其透露,我国正在加紧推进动物实验和临床实验,在临床实验当中已经初步显示出磷酸氯喹对这一次新型冠状病毒肺炎具有一定的疗效,还在进一步加强研究。

国家卫生健康委医政医管局副局长焦雅辉则解释道,“有效”是在实验室体外细胞做出来的结果,这个结果离临床效果之间还有很长的一段路要走,还要经过动物实验,经过人体的临床研究等。
首都医科大学宣武医院药学部主任、国家药物临床试验机构副主任张兰接受澎湃新闻采访时也表示,人体是一个很复杂的体系,在体外对病毒有效的物质,进入人体之后是不是还能发挥一样的作用,体外实验和体内实验是完全不同的两个验证体系。
也就是说,体外细胞实验成功离着临床试验确认人体有效还差着十万八千里。
那么,到底新药从研发到在人体有效、上市需要经过怎样的漫长过程呢?
“新药研发是个漫长的过程”
根据国家药监局公开的资料显示,新药研发到上市,一般要经过临床前研究(包括2-3年的研究开发和2-4年的临床试验)、临床研究(一般3-7年)、新药申请、批准上市四个阶段,时间战线很长。据了解,瑞德西韦从开始研发到现在已经用了将近10年的时间。
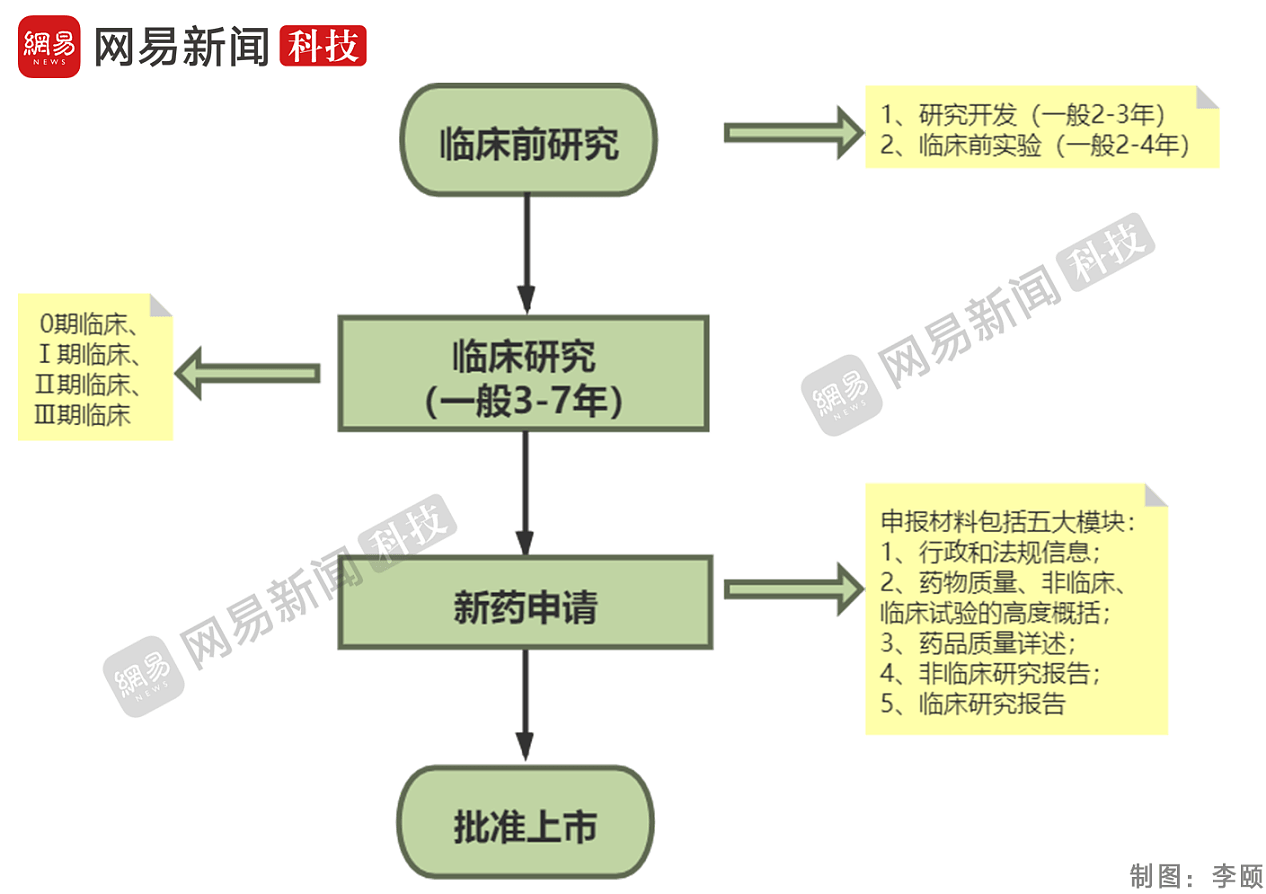
在临床前研究阶段,要做安全性药理及毒理研究,即证明药物的有效化合物针对特定目标疾病具有生物活性,同时评估药物可能的副作用。
这个阶段主要通过体外试验(发生于试管内的实验)、动物试验发现药物有效化合物的所有毒性情况。这也是临床前实验的阶段,这一阶段目的一则是评估药物的药理和毒理作用,药物的吸收、分布、代谢和排泄情况。二是进行生产工艺、质量控制、稳定性等研究。
这一部分的实验需要在动物层面展开,细胞实验的结果和活体动物实验的结果有时候会有很大的差异,这一步的目的是确定药物的有效性与安全性,第二步需要在符合GMP要求的车间完成。
通过临床前试验后,药物才能用于人体临床试验。药物用于人体以研究药物性质、疗效、质量的试验,往往有三期。第一期临床20-100例,正常人,主要进行安全性评价;第二期临床100-300例,病人,主要进行有效性评价;第三期临床300-5000例,病人,扩大样本量,进一步评价。
传统意义上,新药的临床研究分为一期Ⅰ(一期)、Ⅱ(二期)和Ⅲ(三期),后来Ⅱ期分为Ⅱa和Ⅱb,很大程度因为肿瘤药物研究,接着出现了0期研究的概念,然后又有人提出了0/Ⅰ期为早期临床研究,Ⅱa为中期临床研究,Ⅱb和Ⅲ期为晚期临床研究。
完成所有阶段的临床试验,药物的安全性和有效性得到证明后,药物持有人方可向药监部门提交新药申请。新药申请获得药监部门批准后,即可正式上市销售,供医生和病人选择。
按照流程来说,新药从研制到上市需要严格步骤和实验。但是此次疫情事发突然,步骤流程在加快。
“新药研发是一个非常漫长的过程,这样一场突如其来的疫情,我们没有办法按照新药研发的传统规律来开展,所以在第一时间,科技部组织相关的专家进行攻关,充分利用现有的已经具备的研究基础,在已经上市和已经开展临床试验的药物当中进行系统化、大规模的筛选,已经取得了一定成绩。”科技部生物中心副主任孙燕荣在2月4日,国家卫生健康委召开的新闻发布会上这样解释道。
而在众多体外抗病毒活性的药物中,瑞德西韦被率先投入人体临床试验中。孙燕荣解释,瑞德西韦在国外已经应用于治疗埃博拉病毒感染的药物,目前在国外没有完成全部的临床实验,但在相关科研中已经展现出了较好的效果。
因此,国家药监局通知申请单位中日友好医院和中国医学科学院可以开展临床试验。“我们也期待在临床试验中能够取得良好的疗效。”孙燕荣提到。
瑞德西韦:还需等待严格的科学试验结果
瑞德西韦是美国公司吉利德公司研发的药物。该药物是一种核苷酸类似物前药,能够抑制依赖RNA的RNA合成酶(RdRp)。这款在研药物原本是针对埃博拉病毒进行研发的。
瑞德西韦证实了对非典型性肺炎(SARS)和中东呼吸综合征(MERS)的病毒病原体均有活性。这些病毒均属于冠状病毒,且与2019-nCoV新型冠状病毒的结构相似。
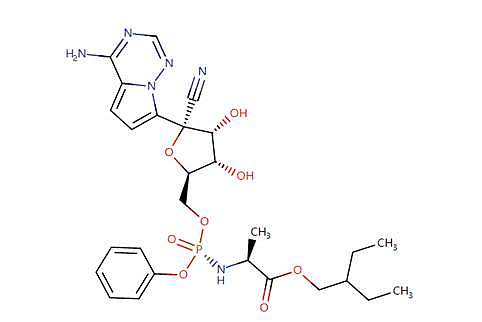
瑞德西韦结构式
今年(2020年)1月31日,《新英格兰医学杂志》发表的一篇关于美国首例新型冠状病毒患者就医、诊断、治疗及其临床表现的论文显示,患者在病情恶化后的1月26日,接受了瑞德西韦的注射治疗,症状出现了大幅改善。
2月2日,中日友好医院官网发布消息称,中日友好医院在武汉疫区牵头开展瑞德西韦治疗2019-nCoV新型冠状病毒临床研究,媒体称这一决定为抗击疫情带来曙光。
中科院武汉病毒所在2月4日也表示,发现瑞得西韦和磷酸氯喹能在体外有效抑制新型冠状病毒。并在1月21日申报了中国发明专利(抗2019新型冠状病毒的用途),并将通过PCT(专利合作协定)途径进入全球主要国家。
瑞德西韦试验将入组轻、中症患者308例,重症患者453例,将执行严格的随机(患者吃的药物按安慰剂组、全量组、半量组等随机发放)、双盲(医生和患者均不知道患者服用的是药物还是安慰剂)试验。
中国工程院副院长、中国医学科学院院长王辰院士在启动会上表示,各界对这一试验有期望,但有无效果,还需要等待严格的科学试验结果。
而针对最近热议的抗病毒“特效药”,钟南山近日也表示,临床试验可以加快绿色通道,但必须走程序。“很多实验室找到一个苗头,就希望马上完全进入临床,这个要小心,伦理审查一定要通过。临床医生还是要按临床的规矩来做。”







 +61
+61 +86
+86 +886
+886 +852
+852 +853
+853 +64
+64


